Artigo
|
|
| O que o potencial de circuito aberto pode nos informar sobre a resistência à corrosão de ligas de alumínio? To what extent can the open circuit potential provide insights into the corrosion resistance of aluminium alloys? |
|
João Victor de S. AraujoI,* I Instituto de Pesquisas Energéticas e Nucleares, Universidade de São Paulo, 05508-000 São Paulo - SP, Brasil Recebido: 21/07/2025; *e-mail: jvaraujo@alumni.usp.br Editor Associado responsável pelo artigo: Eduardo M. Richter This paper examines the effectiveness of using open circuit potential measurements as a standalone technique to assess the corrosion resistance of metals. As a case study, we used different brands of aluminum alloys exposed to 0.1 mol L-1 NaCl solution. Five materials were compared: high-purity aluminium (99.999%) and four commercial alloys (1050-T0, 2024-T3, 2198-T851, and 7475-T761). Open circuit potential (OCP) monitoring as a function of time, potentiodynamic polarization tests, surface and cross-sectional microscopy were employed to investigate the electrochemical behaviour and the localized corrosion resistance of these alloys. Despite exhibiting nobler OCP values, 2024-T3 and 2198-T851 showed severe localized attack, including intergranular and crystallographic pitting. In contrast, only high-purity aluminium developed a stable passive film. Depth measurements revealed that 2024-T3 experienced the deepest attack (121 ± 15 μm), followed by high-purity aluminium (91 ± 12 μm), 2198 (36 ± 7 μm), 1050 (31 ± 6 μm), and 7475 (26 ± 5 μm). These findings demonstrate that OCP measurements, being dominated by the matrix-average potential, do not reflect critical microstructural features that influence localized corrosion. Therefore, while OCP may be useful for preliminary assessment and educational applications, it should be supplemented with kinetic and morphological analyses for a reliable evaluation of corrosion in complex alloy systems. INTRODUÇÃO O potencial de circuito aberto (OCP, do inglês open circuit potential) é definido como o potencial espontâneo estabelecido entre um eletrodo metálico e um eletrodo de referência, na ausência de corrente elétrica imposta ao sistema.1 Em sistemas onde ocorre uma única reação de equilíbrio, genericamente representada como Mez+ + ze− ⇌ Me (Me representando um metal), o OCP reflete o equilíbrio termodinâmico na interfase metal/solução e é denominado potencial de equilíbrio.2 Por outro lado, em sistemas em que ocorrem duas ou mais reações distintas, com pelo menos uma de oxidação e outra de redução, este potencial representa o estado estacionário entre todas as reações, sendo o número de elétrons cedidos pela reação (reações) de oxidação igual ao número de elétrons recebidos pela reação (reações) de redução, garantindo a eletroneutralidade do sistema.3 No caso específico da corrosão, normalmente tem-se a reação oxidação do metal (anódica) e a redução do hidrogênio e/ou do oxigênio como reação (reações) catódica (as), sendo o OCP normalmente denominado de potencial de corrosão (Ecorr).4 O OCP é influenciado por fatores como a composição do meio, a natureza e pureza do metal, a presença de filmes passivos, a adsorção de espécies à superfície metálica, dentre outros.4 O monitoramento da evolução temporal do OCP para um eletrodo em situação de corrosão pode fornecer informações sobre processos dinâmicos, como formação ou dissolução de óxidos, adsorção de inibidores e transições entre estados passivos e ativos da superfície.5 Porém, como será evidenciado no presente trabalho, a interpretação atribuída a essa variável não pode ser dissociada do conhecimento da microestrutura dos materiais que estão sendo estudados. O avanço tecnológico e a crescente adoção de técnicas eletroquímicas mais sofisticadas têm levado à progressiva exclusão da abordagem de tópicos básicos nos cursos de formação acadêmica.3 Entre eles, o significado das medidas de OCP tem sido frequentemente negligenciado em aulas teóricas e práticas, bem como pouco explorado em investigações científicas.6,7 Agostinho et al.8 destacaram essa tendência, ressaltando que a ausência de experimentos simples, como o monitoramento do OCP, compromete a formação conceitual de estudantes e dificulta a compreensão dos fenômenos na interface metal/solução. O estudo de Agostinho et al.8 demonstrou que a medida do OCP pode revelar informações relevantes sobre passivação, adsorção de inibidores, influência do pH, efeitos da aeração e mecanismos anódicos e catódicos em diferentes sistemas metálicos, reforçando seu valor como ferramenta introdutória em cursos de eletroquímica e corrosão. Quando acompanhadas de análise crítica, medidas de OCP favorecem a consolidação da compreensão dos fundamentos eletroquímicos e o desenvolvimento de interpretações mais robustas sobre o comportamento de materiais metálicos em meios agressivos.8 Por outro lado, o uso isolado de valores de OCP como instrumento para classificar a resistência à corrosão de metais, sem o suporte de técnicas complementares, pode conduzir a interpretações limitadas e/ou equivocadas.5 Embora alguns autores associem, erroneamente, o OCP a aspectos termodinâmicos, na verdade, essa caracterização depende do contexto específico da reação eletroquímica envolvida.9 Quando o sistema se encontra em equilíbrio eletroquímico, ou seja, quando ocorre uma única reação reversível, o potencial medido pode ser interpretado como o potencial de equilíbrio, de natureza termodinâmica.10 No entanto, na maioria das situações práticas, especialmente em sistemas corrosivos, o OCP corresponde a um estado estacionário, resultante do balanço entre as reações de oxidação e redução simultâneas, o que implica predominância de fatores cinéticos.10 No caso de se ter a corrosão do metal ou liga metálica, o OCP reflete o Ecorr do sistema, influenciado pelas taxas das reações anódicas e catódicas, que podem ser profundamente influenciadas pela microestrutura.11 Apesar da ampla utilização do OCP na literatura para caracterização eletroquímica de diversos materiais,10,12-14 incluindo ferro,15 cobre,16 aço inoxidável17,18 e ligas odontológicas,19 as limitações do seu significado, conforme mencionado nos parágrafos anteriores, muitas vezes não são devidamente discutidas. Por exemplo, em ligas de alumínio de alta resistência mecânica, embora haja um número crescente de estudos que empregam o OCP como parâmetro de análise, ainda são escassas as abordagens críticas quanto à sua real aplicabilidade e capacidade de refletir a resistência à corrosão.12,20-22 Diante disso, este trabalho tem como objetivo avaliar a aplicabilidade e as limitações do OCP como parâmetro indicativo do comportamento quanto à corrosão de ligas de alumínio de alta resistência. Serão investigadas a estabilidade do potencial ao longo do tempo e sua correlação com técnicas complementares, como polarização anódica e caracterização morfológica. A proposta é contribuir para o entendimento do comportamento dessas ligas em ambientes corrosivos e para a valorização crítica das medidas de OCP como ferramenta de apoio no ensino e na pesquisa em corrosão.
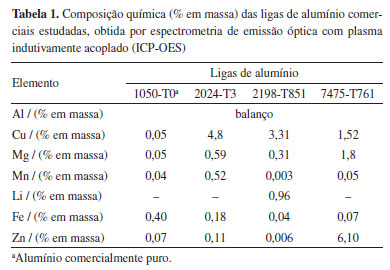
PARTE EXPERIMENTAL Materiais Neste estudo, foram investigados cinco materiais: alumínio puro (99,999% em massa) e quatro ligas comerciais com distintas composições químicas e características metalúrgicas. As ligas analisadas foram: 1050-T0 (Al-Fe), 2024-T3 (Al-Cu-Mg), 2198-T851 (Al-Cu-Li) e 7475-T761 (Al-Zn-Mg). A Tabela 1 apresenta a composição química dessas ligas, com destaque para os principais elementos de liga presentes em cada uma delas.
Preparação metalográfica das amostras Antes da realização dos ensaios eletroquímicos, a superfície das amostras de alumínio foi preparada por lixamento sequencial com lixas de carbeto de silício (SiC) de granulações No. P2000, No. P2500 e No. P4000. Em seguida, foi realizado polimento com suspensão de diamante de 3 µm e, posteriormente, de 1 µm. A área exposta ao eletrólito durante os ensaios foi de 1 cm2, delimitada com cera de abelha a fim de evitar a ocorrência de corrosão em fresta. Ensaios eletroquímicos Os ensaios eletroquímicos foram realizados em solução naturalmente aerada de NaCl 0,1 mol L-1 (800 mL), à temperatura ambiente (ca. 25 °C), utilizando uma célula eletroquímica convencional de três eletrodos. O eletrodo de trabalho foi composto por amostras do alumínio e das ligas previamente preparadas, conforme descrito anteriormente. Utilizou-se um eletrodo de referência de Ag|AgCl|KCl 3 mol L-1, e um contra eletrodo de platina com área aproximada de 5 cm2. As medições foram conduzidas com auxílio de um potenciostato modelo SP-200 (Biologic®), em célula aberta, com aeração natural do meio. Todos os ensaios foram realizados em triplicata, com boa reprodutibilidade entre as medidas. O comportamento eletroquímico dos materiais foi avaliado por dois procedimentos distintos: (i) monitoramento do potencial de circuito aberto (OCP) por um período contínuo de 24 h; (ii) ensaios de polarização potenciodinâmica anódica, conduzidos após 15 min de imersão das amostras, com uma taxa de varredura de 1 mV s-1, iniciando-se em um potencial 20 mV abaixo do OCP e finalizando em 0 V vs. Ag|AgCl|KCl 3 mol L-1. Observação da corrosão após os ensaios eletroquímicos Após a realização dos ensaios eletroquímicos, as superfícies das ligas de alumínio foram analisadas por microscopia óptica e microscopia eletrônica de varredura (MEV). As imagens ópticas foram obtidas com um microscópio Leica, modelo DMLM, enquanto as análises por MEV foram realizadas utilizando o equipamento Hitachi TM3000, operando com detector de elétrons retroespalhados (BSE) e tensão de aceleração de 15 kV. Antes das observações por MEV, os produtos de corrosão foram removidos por imersão das amostras em solução de ácido nítrico (HNO3) 30% v/v, durante 5 min, em banho ultrassônico à temperatura ambiente (ca. 25 °C). Nesta concentração o ácido nítrico atua como passivante e não ataca a superfície do alumínio durante a remoção dos produtos de corrosão. A profundidade dos ataques localizados (pites), após os ensaios de polarização anódica, foi estimada com base na norma ASTM G46-21,23 que permite a medição óptica da diferença de foco entre a superfície externa e o fundo do pite. Para cada liga, foram analisados 25 pites. Adicionalmente, cortes transversais foram cuidadosamente realizados nas regiões afetadas por corrosão localizada, utilizando disco diamantado. As seções foram posteriormente lixadas até a granulação No. P4000 e polidas com pasta de diamante de 1 µm, para posterior caracterização morfológica.
RESULTADOS E DISCUSSÃO A Figura 1 apresenta as curvas de OCP obtidas ao longo de 24 h de imersão em solução de NaCl 0,1 mol L-1 para o alumínio puro (99,999 %) e para as ligas comerciais.
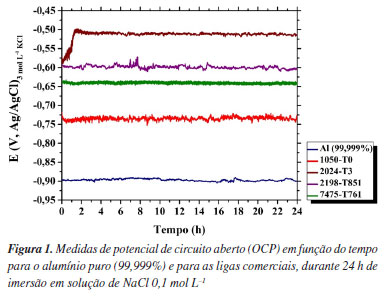
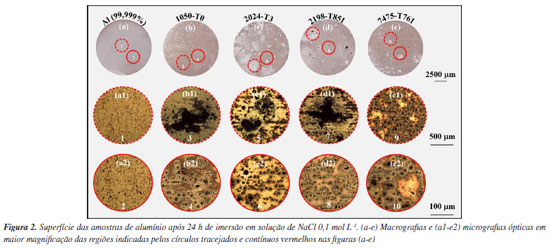
Após 24 h de exposição, o alumínio puro apresentou o potencial mais negativo entre os materiais, com valor médio de cerca de -0,91 V enquanto a liga 1050-T0 exibiu um potencial de -0,75 V, ou seja, 0,16 V mais positivo em relação ao alumínio puro; a liga 7475-T761 mostrou um potencial de -0,64 V, sendo 0,27 V mais nobre que o Al puro e 0,11 V mais positiva que a liga 1050-T0, todos os potenciais medidos vs. Ag|AgCl|KCl 3 mol L-1. A liga 2198-T851 apresentou um valor de -0,59 V vs. Ag|AgCl|KCl 3 mol L-1, correspondendo a um deslocamento de 0,32 V em relação ao potencial do alumínio puro. Por fim, a liga 2024-T3 registrou o valor mais elevado entre todas as amostras, com potencial de -0,51 V vs. Ag|AgCl|KCl 3 mol L-1, ou seja, uma diferença de 0,40 V quando comparado ao alumínio puro. A análise dos valores de OCP obtidos experimentalmente, em conjunto com a composição química apresentada na Tabela 1, revela uma tendência crescente de nobreza eletroquímica com o aumento do teor de elementos de liga, especialmente de cobre. Esse comportamento sugere que ligas como 2024-T3 e 2198-T851, com maiores teores de cobre, tendem a apresentar potenciais de circuito aberto mais positivos, indicativos de um comportamento eletroquímico mais nobre do ponto de vista termodinâmico. Em uma interpretação preliminar, potenciais menos negativos são frequentemente associados à presença de filmes passivos mais estáveis e, portanto, a uma suposta maior resistência à corrosão.24 Porém, como será revelado pelos resultados obtidos no presente estudo, esta interpretação pode ser precipitada se não forem levados em conta aspectos específicos das microestruturas dos materiais, e que influenciam na cinética das reações interfaciais. A fim de verificar se os maiores valores de potenciais de circuito aberto registrados podem ser realmente associados a uma maior resistência à corrosão das ligas avaliadas, foi realizada a caracterização morfológica das superfícies após 24 h de exposição no eletrólito teste, conforme apresentado na Figura 2.
A análise das macros e micrografias apresentadas na Figura 2 indica que o comportamento frente à corrosão das ligas não pode ser correlacionado diretamente com a tendência de nobreza sugerida pelos valores de OCP (Figura 1). As macrografias (Figuras 2 (a-e)) e as micrografias ópticas (Figuras 2 (a1-e2)) revelam variações significativas na intensidade e morfologia do ataque entre os diferentes materiais. O alumínio puro (Figuras 2 (a-a2)), apesar de exibir o potencial mais negativo, apresentou a superfície menos atacada e mais uniforme, com sinais de ataque generalizado e bem distribuído. Por sua vez, todas as ligas comerciais exibiram evidências de ataque localizado. As ligas 2024-T3 (Figuras 2 (c-c2)), 2198-T851 (Figuras 2 (d-d2)) e 1050-T0 (Figuras 2 (b-b2)) apresentaram regiões escurecidas, indicativas de acúmulo de produtos de corrosão, além da presença de pites bem definidos. A liga 7475-T761 (Figuras 2 (e-e2)), por sua vez, apresentou ataque pontual distribuído, embora com menor volume de produtos de corrosão. Com o propósito de complementar as observações obtidas por microscopia óptica e caracterizar em maior detalhe a morfologia do ataque na superfície das ligas, foram realizadas análises por microscopia eletrônica de varredura (MEV), portanto, com maiores magnificações, das amostras apresentadas na Figura 2, cujos resultados estão apresentados na Figura 3.

As imagens obtidas antes da remoção dos produtos de corrosão (Figuras 3 (a-e)) revelam variações significativas na morfologia do ataque entre as diferentes amostras. Para o alumínio puro (Figura 3a), observou-se uma superfície majoritariamente lisa, com poucas evidências de corrosão localizada. A partícula isolada, destacada pelo círculo tracejado 1, foi identificada como uma inclusão contendo silício, a partir de resultados de análises químicas pontuais obtidas por espectroscopia por dispersão de energia de raios-X (EDS) acoplada ao MEV. Essas inclusões podem atuar como sítios catódicos (mais nobres), promovendo a dissolução preferencial da matriz de alumínio ao seu redor, através de um efeito microgalvânico.25 A imagem obtida após a remoção dos produtos de corrosão corrobora essa interpretação, uma vez que a partícula não é mais observada e uma cava residual se torna evidente (indicada pela seta amarela no círculo tracejado 2). Para as ligas comerciais (Figuras 3 (b-e)), foram identificadas regiões escurecidas e com morfologias irregulares, associadas a acentuado acúmulo de produtos de corrosão, conforme indicado pelas setas brancas nos círculos tracejados identificados com números ímpares. Essas áreas apresentaram alto contraste nas imagens de MEV, o que pode ser atribuído às diferenças topográficas e à variação na composição local entre os produtos de corrosão e a matriz metálica, resultando em alterações no sinal de elétrons retroespalhados que facilitam a distinção das regiões afetadas pelo ataque corrosivo.26 Após a remoção dos produtos de corrosão (Figuras 3 (a1-e1)), foi possível observar a extensão real do ataque localizado e a morfologia dos pites, que apresentaram características distintas entre as ligas em função de suas composições químicas e históricos de processamento termomecânico. A liga 1050-T0 (Figura 3 (b1)) apresentou corrosão intergranular (CIG), explicada pela presença de partículas dispersas de Al-Fe (conforme indicado no círculo 4 pela seta amarela). Esse tipo de ataque é reportado na literatura25 em ligas de alta pureza com partículas de segunda fase, como Al-Fe, que atuam como sítios catódicos e favorecem a dissolução preferencial nos contornos de grão. Na liga 2024-T3 (Figura 3 (c1)), também observou-se ataque intergranular (indicado no círculo 6 pela seta amarela), porém, neste caso, o ataque está relacionado à presença de precipitados da fase S (AlCuMg) nos contornos de grão, que se tornam enriquecidos em cobre após dissolução preferencial do magnésio e promovem a formação de nanocélulas galvânicas nas quais a matriz de alumínio é o anodo.27 A liga 2198-T851 (Figura 3 (d1)) exibiu pites com orientação preferencial (círculo 8), resultantes do ataque intragranular induzido pela fase nanométrica T1 (Al2CuLi), que precipita no interior dos grãos e atua como sítio anódico.28 A liga 7475-T761 (Figura 3 (e1)) apresentou ataque intergranular, com propagação ao longo dos contornos de grão (círculo 10), comportamento associado à presença de finas partículas anódicas, portanto mais ativas, de MgZn2 precipitadas nesta região, e que são típicas de ligas da série 7000 envelhecidas artificialmente.29 Devido à natureza mais ativa, estas partículas são dissolvidas pela corrosão, criando um caminho para a penetração do eletrólito entre os grãos e alimentando a corrosão. As diferenças microestruturais entre as ligas avaliadas decorrem da composição química e dos efeitos do tratamento termomecânico, que controlam a formação e distribuição de fases intermetálicas, zonas de endurecimento e bandas de deformação plástica.30 É amplamente reconhecido que tais heterogeneidades favorecem a propagação da corrosão localizada pela formação de micro e nanocélulas galvânicas.31-34 Nesse contexto, as micrografias apresentadas nas Figuras 3 (b-e1) demonstram que, nas ligas comerciais, os mecanismos de ataque e propagação da corrosão estão fortemente relacionados à presença de nanoprecipitados, cuja atuação anódica ou catódica contribui para a ativação localizada da superfície. O processo corrosivo, no entanto, não se restringe aos precipitados nanométricos, partículas intermetálicas micrométricas também exercem influência significativa na iniciação da corrosão. A Figura 4 evidencia o comportamento das partículas intermetálicas micrométricas após 24 h de exposição, confirmando seu papel como sítios preferenciais para a iniciação do ataque corrosivo localizado, conforme reportado na literatura.35

As micrografias apresentadas nas Figuras 4a-4d revelam que todas as ligas comerciais apresentaram partículas intermetálicas micrométricas. Essas partículas apresentam morfologia compatível com fases contendo alumínio, cobre e ferro (Al-Cu-Fe),36 cuja formação está associada à presença de elementos de ligas essenciais (por exemplo o Cu) juntamente com impurezas originadas durante o processo de fundição, as quais não são completamente eliminadas durante o processamento termomecânico subsequente. Estudos prévios37 descrevem essas partículas como eletroquimicamente mais nobres do que a matriz de alumínio, atuando como sítios catódicos e promovendo a formação de microcélulas galvânicas quando expostas a ambientes agressivos. Em maiores magnificações (Figura 4e), observa-se a formação de cavidade ao redor dessas partículas, indicando a dissolução seletiva da matriz adjacente. Esse fenômeno é característico do ataque localizado induzido por acoplamento galvânico entre a matriz de alumínio, mais anódica, e as partículas intermetálicas de comportamento catódico. As setas brancas nas Figuras 4a e 4e indicam as cavidades formadas ao redor das partículas, evidenciando a corrosão na interface partícula/matriz, favorecida pela redução de oxigênio ou hidrogênio sobre a superfície do intermetálico. A recorrência desse mecanismo em todas as ligas comerciais, independentemente da composição global, reforça o papel crítico das partículas intermetálicas na iniciação do ataque corrosivo. É importante destacar que mesmo quando compostas pelos mesmos elementos, tais partículas podem exibir atividades eletroquímicas diferentes, pois podem apresentar composições (proporções entre os elementos) diferentes. Uma amostra da diversidade e variabilidade de composição das partículas pode ser verificada no trabalho de Birbilis38 e Buchheit.39 Os resultados apresentados nas Figuras 1-3 demonstram que o fato do material exibir um potencial mais nobre em circuito aberto (OCP) não constitui, isoladamente, um parâmetro confiável para inferir a resistência à corrosão localizada, especialmente em ligas que apresentam heterogeneidades microestruturais, como inclusões e partículas intermetálicas. Diante disso, impõe-se uma questão: O que explica o fato de ligas como 2024-T3, 2198-T851 e 7475-T761, que exibiram OCP mais positivos ao longo das 24 h de ensaio, terem apresentado maior suscetibilidade à corrosão localizada do que o alumínio puro e a liga 1050-T0, cujos potenciais permaneceram mais negativos? A resposta pode estar em fatores associados à microestrutura e a termodinâmica. Estudos prévios24 já indicam que o OCP pode não refletir adequadamente a atividade eletroquímica local de regiões altamente reativas, cuja contribuição para o potencial global é limitada, embora localmente intensa. Como a matriz metálica constitui a maior parte da superfície exposta, sua resposta tende a predominar na medição do OCP, limitando a detecção da atividade eletroquímica de regiões ativas, como contornos de grão, partículas intermetálicas e até mesmo precipitados nanométricos, que frequentemente atuam como sítios preferenciais para a iniciação da corrosão localizada. A Tabela 2 apresenta os potenciais de equilíbrio padrão do Al e de alguns dos principais elementos encontrados na composição das diferentes ligas: Zn, Fe e Cu.

O Fe, que é uma impureza, é o principal elemento presente na liga 1050-T0, com 0,40%, o Zn e o Cu estão presentes na liga 7475-T761, com 6,10 e 1,52%, respectivamente, enquanto o Cu é o principal elemento de liga nas ligas 2024-T3 (4,80%) e 2198-T851 (3,31%). Assim, a presença do Fe explicaria o maior OCP verificado para a liga 1050-T0 em relação ao alumínio puro, enquanto o Cu, principalmente, seria responsável pelos OCPs mais elevados apresentados pelas demais ligas, cujos valores aumentam com o aumento de seu teor na composição da liga. A contribuição destes elementos para o aumento do OCP está associada tanto à sua presença em solução sólida, como, principalmente, à sua precipitação em partículas constituintes (intermetálicos e precipitados de endurecimento) que se comportam de modo mais nobre em relação à matriz, despolarizando as reações catódicas e contribuindo para o aumento do OCP. O Zn, apesar de apresentar potencial de equilíbrio superior ao Al, se comporta anodicamente, devido à presença da camada passiva típica do Al e de suas ligas. Assim, apesar das ligas 2024-T3, 2198-T851 e 7475-T761 apresentarem OCPs mais positivos (Figura 1), a elevada densidade, reatividade e distribuição heterogênea de partículas intermetálicas e nanoprecipitados contribuem significativamente para a nucleação de pites e a propagação do ataque corrosivo intergranular, como evidenciado nas Figuras 2 e 3. A severidade desse ataque está diretamente relacionada ao tamanho, composição e distribuição dessas partículas, bem como à estabilidade do filme passivo formado sobre a matriz de alumínio em suas proximidades e a própria composição da liga.41 No caso da liga 2024-T3, em particular, estudos indicam que sua microestrutura contém até seis vezes mais partículas intermetálicas micrométricas do que outras ligas com menores teores de elementos de liga, o que intensifica a formação de microcélulas galvânicas e a dissolução localizada da matriz.36,42 Além disso, a elevada densidade de partículas intermetálicas contendo cobre pode favorecer o enriquecimento superficial desse elemento durante as etapas iniciais do processo corrosivo, o que pode contribuir para o aumento abrupto do potencial registrado nas primeiras horas de ensaio, antes da estabilização observada para a liga 2024-T3 (Figura 1). Para a liga 2024-T3, esse comportamento está associado à dissolução seletiva das partículas intermetálicas Al-Cu-Mg, resultando em enriquecimento em cobre, o que as torna catódicas em relação à matriz.43-46 Esse aumento no teor de cobre superficial leva a um aumento do OCP, e tem sido associado na literatura41,47 a uma falsa indicação de passivação, elevando o OCP, embora sem representar uma proteção efetiva contra a corrosão. Assim, ainda são recorrentes na literatura interpretações que associam valores mais nobres de OCP a uma suposta maior resistência à corrosão, sem considerar as limitações dessa técnica diante de processos de corrosão localizada. No estudo de Codaro,48 por exemplo, o OCP foi utilizado como parâmetro comparativo entre diferentes ligas de alumínio tratadas termicamente, sendo interpretado como um indicativo direto de resistência à corrosão, uma abordagem cuja limitação torna-se evidente diante dos resultados experimentais apresentados neste trabalho, especialmente no que diz respeito à atuação de regiões microestruturalmente ativas. Como exposto anteriormente, o OCP espelha o potencial de corrosão (Ecorr) do sistema, determinado pelo estado estacionário entre as reações anódicas e catódicas que ocorrem na interface metal/solução com a mesma intensidade, garantindo a eletroneutralidade do sistema. O presente estudo não tem por objetivo apresentar a caracterização microestrutural das ligas, porém, no decorrer da investigação foi verificada a existência de intermetálicos ricos em Fe, Cu e Fe/Cu na microestrutura das diferentes ligas, os quais, comprovadamente, são catódicos em relação às matrizes das ligas de alumínio.10,14,31-34,37,49-51 Assim, durante a corrosão, estes intermetálicos mais nobres, são polarizados catodicamente, e são os principais sítios onde as reações catódicas irão ocorrer, ou seja, são os locais onde as espécies oxidantes se reduzem. Por sua vez, a matriz da liga é polarizada anodicamente, e a principal reação anódica é a oxidação do alumínio, concentrada primordialmente nos arredores dos intermetálicos, onde há rompimento localizado da camada de óxido, favorecendo a propagação da corrosão. Portanto, a diferença de potencial entre os intermetálicos e a matriz da liga, dependente da composição de ambas as fases, tem um papel importante no valor do potencial de corrosão assumido pela liga e, consequentemente, na intensidade da corrosão. É importante destacar que em ligas de alumínio de elevada resistência mecânica, como as utilizadas no presente estudo, podem existir intermetálicos com composições variadas, que dependem tanto do tipo de liga como do tratamento termomecânico empregado na produção desta.38,39,52-54 Outro papel importante dos intermetálicos para a determinação do potencial de corrosão diz respeito à cinética das reações catódicas, que, em solução aquosa, são primordialmente a reação de evolução do hidrogênio (REH) e a reação de redução do oxigênio (RRO). Embora podendo ser afetada pela composição da matriz, que pode modificar sua composição, a natureza isolante do óxido de alumínio faz com que estas reações sejam muito lentas sobre a matriz protegida, com densidades de corrente de troca (i0) entre 10-12 e 10-10 A cm-2, o que explica a baixa corrosão apresentada pelo alumínio puro na presença destes dois oxidantes. Por outro lado, as cinéticas destas reações são bem mais rápidas sobre o Fe e o Cu. Sobre o primeiro metal, os valores aproximados de i0 estão entre 10-7 e 10-6 A cm-2, e entre 10-9 e 10-7 A cm-2, para a REH e RRO, respectivamente. Já para o Cu, estes valores se situam entre 10-8 e 10-7 A cm-2 (REH) e 10-9 e 10-7 A cm-2 (RRO). Assim, nas ligas, as cinéticas das reações catódicas sobre os intermetálicos são bem mais rápidas do que sobre a matriz, contribuindo para aumentar a velocidade de corrosão, já que os elétrons gerados pela oxidação do alumínio e que são direcionados aos intermetálicos mais nobres serão mais rapidamente consumidos pelas espécies oxidantes.1,2,55 Como já destacado anteriormente, o alumínio será oxidado preferencialmente nas regiões onde ocorre o rompimento da película passiva, gerando corrosão localizada. A Figura 5 apresenta esquematicamente o efeito da diferença de potencial (Figura 5a) e da densidade de corrente de troca (Figura 5b) sobre o valor do potencial de corrosão de um metal.
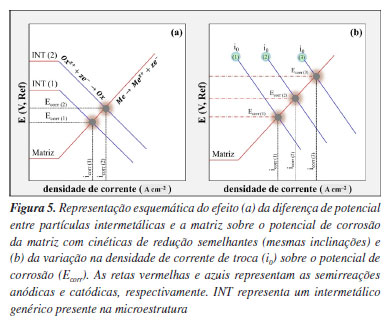
Na Figura 5a, observa-se que enquanto os potenciais das duas partículas são diferentes, as inclinações das retas referentes às reações catódicas são iguais, apontando para cinéticas semelhantes das reações de redução. Assim, se na microestrutura da liga genérica existir um intermetálico (INT) com a composição (1) esta apresentará potencial de corrosão Ecorr(1) e densidade de corrente de corrosão icorr(1). Porém, se esta mesma liga apresentar em sua microestrutura um intermetálico (INT) com a composição (2), que apresenta maior diferença de potencial em relação à matriz, estes valores serão Ecorr(2) e icorr(2). Nota-se que, enquanto na presença do intermetálico 2 (INT(2)) a liga apresenta comportamento mais nobre, pois Ecorr(2) > Ecorr(1), sua velocidade de corrosão será mais elevada, pois icorr(2) > icorr(1). Isto ocorre porque na presença do INT(2), mais nobre, a matriz da liga sofre uma polarização anódica mais intensa. É importante destacar que as reações catódicas ocorrem sobre os intermetálicos, que estão polarizados catodicamente, ou seja, as partículas também se encontram no potencial de corrosão. Por sua vez, a Figura 5b apresenta, esquematicamente, a associação entre uma liga e um intermetálico mais nobre, sobre este estão representadas três hipotéticas reações catódicas com diferentes valores de i0: i0(1) < i0(2) < i0(3), onde quanto maior o valor de i0 mais rápida a cinética da reação. Cada cinética de reação está associada a uma composição diferente do intermetálico, e a inclinação das três retas catódicas é idêntica, indicando mecanismos de reações semelhantes, ou seja, trata-se da mesma reação catódica. Verifica-se que, quando a cinética da reação sobre o intermetálico aumenta, maior valor de i0, ocorre aumento do potencial de corrosão, ou seja, a liga se torna mais nobre, mas isto também provoca aumento de icorr, apontando para maior suscetibilidade ao processo corrosivo. Destaca-se mais uma vez que a reação catódica ocorre sobre o intermetálico, que se encontra polarizado catodicamente, e que o valor do potencial da partícula é igual ao potencial de corrosão determinado. Outro fator importante para a determinação do potencial de corrosão e velocidade de corrosão, que, no entanto, não será abordado no presente trabalho, diz respeito à relação entre a área catódica (basicamente a porcentagem da superfície da amostra recoberta por intermetálicos) e a área anódica (superfície da matriz exposta). Como materiais diferentes podem apresentar diferentes quantidades de intermetálicos em sua microestrutura, a intensidade das reações catódicas pode variar entre diferentes materiais, afetando a velocidade da reação anódica (lembrando que, em um metal em corrosão, ambos os processos devem ocorrer com a mesma intensidade) também modificando o valor do potencial e da velocidade de corrosão. Uma discussão esclarecedora sobre este aspecto pode ser encontrada no trabalho de Liao e Wei.56 Os esquemas simplificados apresentados na Figura 5 mostram que tanto a diferença de potencial entre os intermetálicos e a matriz como a cinética das reações de redução sobre os mesmos, ambas variáveis dependentes da composição dos intermetálicos, afetam o valor do potencial de corrosão e a velocidade de corrosão da matriz. Essas relações são confirmadas pelas curvas de polarização anódica experimentais obtidas para as ligas avaliadas, que possuem microestruturas diferentes, nas quais os valores de Ecorr diferem entre si, e se aproximam dos potenciais de OCP previamente registrados. A Figura 6 apresenta essas curvas, permitindo uma comprovação experimental desses efeitos, complementando a interpretação fornecida pelas curvas de OCP e pela caracterização microestrutural.
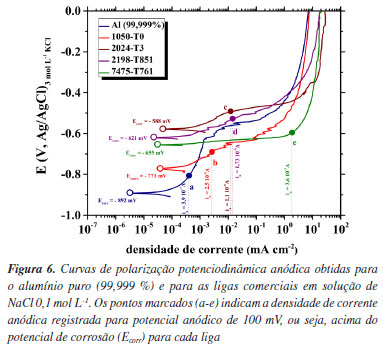
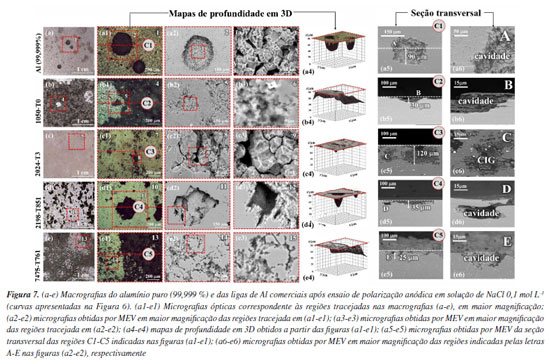
As curvas de polarização anódica apresentadas na Figura 6 revelam diferenças significativas no comportamento eletroquímico das ligas de alumínio avaliadas. Os valores de potencial de corrosão (Ecorr) mostraram-se consistentes com os dados de OCP previamente discutidos, confirmando o comportamento de deslocamento para potenciais mais positivos, onde foi obedecida a mesma sequência de nobreza: alumínio puro (-892 mV vs. Ag|AgCl|KCl 3 mol L-1), 1050‑T0 (-771 mV vs. Ag|AgCl|KCl 3 mol L-1), 7475-T761 (-655 mV vs. Ag|AgCl|KCl 3 mol L-1), 2198-T851 (-621 mV vs. Ag|AgCl|KCl 3 mol L-1) e 2024-T3 (-588 mV vs. Ag|AgCl|KCl 3 mol L-1). Em concordância com as análises microestruturais apresentadas nas Figuras 2 e 3, observa-se que valores mais nobres de Ecorr não correspondem, de forma direta, a uma maior resistência à corrosão, o que está relacionado aos fatores microestruturais. Nas curvas de polarização da Figura 6, o alumínio puro foi o único material a apresentar uma região passiva bem definida, caracterizada por uma densidade de corrente anódica praticamente constante, em torno de 3,3 × 10-7 A cm-2. Esse comportamento indica a presença de um filme passivo estável, capaz de proteger a superfície contra a corrosão em meio contendo íons cloreto.35 Por outro lado, todas as ligas comerciais apresentaram aumento contínuo da densidade de corrente em potenciais superiores ao Ecorr, indicando a inexistência de uma passivação eficaz ou a instabilidade do filme protetor formado, mesmo no potencial de circuito aberto, o que está diretamente ligado à microestrutura. Para efeito comparativo, para cada material, foi determinada a densidade de corrente anódica (ia) em um potencial 100 mV mais positivo que o Ecorr. Os valores obtidos nos pontos destacados (a-e) na Figura 6 foram: Al 99,999% (3,9 × 10-7 A cm-2), 1050‑T0 (2,5 × 10-6 A cm-2), 2024-T3 (1,1 × 10-5 A cm-2), 2198-T851 (1,7 × 10-5 A cm-2) e 7475-T761 (3,6 × 10-3 A cm-2). Assim, embora o alumínio puro tenha apresentado o menor potencial de corrosão, ele foi o material com a menor densidade de corrente no regime anódico, além de indicar comportamento passivo estável, confirmando sua maior resistência à corrosão. A liga 1050-T0 apresentou uma pequena região de passivação, seguida por um aumento gradual da corrente com o potencial, indicando que o filme passivo é menos resistente à polarização, embora ainda mais estável que o observado para as ligas endurecidas por precipitação. Em relação ao alumínio puro, as ligas 2024-T3 e 2198-T851 apresentaram densidades de corrente anódica aproximadamente duas ordens de grandeza superiores, refletindo maior suscetibilidade à propagação da corrosão sob polarização anódica. A liga 7475-T761 apresentou o pior desempenho entre os materiais analisados, com densidade de corrente aproximadamente quatro ordens de grandeza superior à do alumínio puro, indicando falhas na estabilidade da camada passiva e alta tendência à corrosão na presença de íons cloreto.20 Para esta liga em particular, verifica-se que, na comparação entre os potenciais de corrosão ela apresentou comportamento intermediário, porém apresentou o pior desempenho sob condição de polarização anódica. Esta resposta também pode ser explicada pela termodinâmica e pela microestrutura da liga. Dentre todas as ligas estudadas, a 7475-T761 é a mais rica em Zn e Mg (Tabela 1). Estes elementos são mais ativos que a matriz de alumínio,57-59 e, após tratamento térmico de envelhecimento, precipitam na forma de precipitados submicrométricos de MgZn2 que também são anódicos em relação à matriz.60,61 A corrente adicional gerada pela dissolução dos nanoprecipitados quando a liga está sob condição de polarização anódica pode explicar parcialmente a resposta observada, visto que a corrente de oxidação dos precipitados MgZn2 se adiciona à da própria matriz, que, por sua vez, se oxida nas regiões onde ocorre falha da camada passiva. Os resultados obtidos reforçam que, embora os valores de Ecorr forneçam informações relevantes e indiscutíveis sobre a nobreza no sentido termodinâmico (veja, por exemplo, que, devido à diferença de potencial, em ligas Alclad o alumínio comercialmente puro, com composição semelhante à liga 1050, e, portanto, menos nobre, fornece proteção catódica para a liga 2024-T3, que é mais nobre),27,62,63 isto não se traduz necessariamente em maior resistência à corrosão. A ausência ou a instabilidade da passivação observada nas ligas comerciais é consequência da microestrutura complexa, que desloca os valores de OCP para potenciais mais positivos, portanto, mais nobres; porém, este aumento de potencial as torna mais ativas eletroquimicamente, destacando a importância de se considerar também fatores cinéticos e microestruturais, que exercem papel determinante na iniciação e propagação do ataque localizado, e que são determinantes para a resistência à corrosão do material. A elevada suscetibilidade à corrosão localizada observada em ligas com potenciais mais nobres evidencia, portanto, uma limitação crítica do uso do OCP como parâmetro isolado na avaliação da resistência à corrosão localizada, uma vez que essa medida não capta adequadamente os efeitos de heterogeneidades microestruturais nem os mecanismos de degradação localizados. Assim, é lícito afirmar que as ligas apresentam potencial mais nobre que o alumínio puro, porém, este aumento na nobreza não se reflete necessariamente em uma maior resistência à corrosão. Com o intuito de sustentar essas observações e estabelecer uma correlação entre o comportamento eletroquímico e os mecanismos morfológicos envolvidos, a Figura 7 apresenta micrografias das superfícies das ligas de alumínio após os ensaios de polarização anódica, levando em consideração tanto a morfologia superficial quanto a propagação do ataque em profundidade a partir da análise do corte transversal da região corroída.
As macrografias apresentadas nas Figuras 7 (a-e) e (a1-e1) revelam diferenças na morfologia e na distribuição do ataque superficial entre as ligas após os ensaios de polarização anódica. Enquanto o alumínio puro (Figura 7a) apresentou poucos pontos de ataque, que mostraram geometria bem definida e predominantemente circular, as ligas comerciais exibiram superfícies mais degradadas, com ataque intenso e morfologicamente irregular. Como já discutido, essas diferenças estão associadas às heterogeneidades microestruturais resultantes do processamento de fabricação de cada liga. No alumínio puro e na liga 1050-T0, Figuras 7 (a3 e b3), respectivamente, observou-se cavidades com contornos bem definidos, características de ataque cristalográfico. Esse tipo de ataque está associado à menor heterogeneidade microestrutural desses materiais quando comparados às ligas comerciais, favorecendo a dissolução preferencial ao longo de planos cristalográficos específicos, em vez de processos mediados por partículas intermetálicas.64 A morfologia do ataque observada nas ligas comerciais após os ensaios de polarização (Figuras 7 (c2-e2)) confirmou os mecanismos de corrosão previamente identificados nos ensaios de imersão (Figura 3), evidenciando que o comportamento frente à corrosão localizada é fortemente influenciado pela microestrutura de cada uma delas. A liga 2024-T3 (Figura 7 (c3)) apresentou CIG pronunciada ao longo dos contornos de grão. Na liga 2198-T851 (Figura 7 (d3)), o ataque ocorreu preferencialmente em regiões com bandas de deformação, enquanto para a liga 7475-T761 (Figura 7 (e3)) ocorreu CIG e propagação cristalográfica. Esses comportamentos refletem, respectivamente, a atuação de partículas Al-Cu-Fe,32-34 da fase T1 (Al2CuLi)12 e de MgZn2 combinada à presença de zonas de precipitação descontínuas (PFZs),65 como discutido em outros trabalhos que abordam corrosão localizada destes materiais.12,20,46,66-69 Nota-se que a morfologia da corrosão após os ensaios de polarização anódica, nas ligas comerciais, é semelhante àquela documentada após 24 h de imersão monitorada por OCP (Figura 3). A principal exceção é o alumínio puro, cuja superfície permaneceu estável durante a imersão (Figura 3a), sem formação visível de cavidades. No entanto, após a polarização (Figura 7 (a3)), foram observados pites bem definidos, mostrando que a aplicação do potencial anódico foi capaz de promover o rompimento local do filme passivo. Esse comportamento é consistente com os dados eletroquímicos apresentados na Figura 7, que evidenciaram uma região passiva bem estabelecida para alumínio de alta pureza, mas também revelaram um aumento de corrente em potenciais mais elevados, correspondente ao potencial de pites, indicando a ocorrência de ruptura do filme passivo, o que ocorre em pontos discretos da superfície. Essas observações resultam em aspectos relevantes que devem ser levados em conta ao se analisar a influência da microestrutura na estabilidade do estado passivo. Enquanto o alumínio de alta pureza tende a formar um filme protetor contínuo e relativamente estável, as ligas comerciais apresentam comportamento mais complexo em razão de sua heterogeneidade microestrutural. Embora exibindo valores de OCP menos negativos, o que muitas vezes tem sido diretamente associado a uma condição eletroquímica mais estável, os comportamentos das ligas devem ser analisados com base na microestrutura, e sua influência nas reações eletroquímicas que ocorrem na interface metal-solução. Assim, a perda de passividade com o aumento do potencial não constitui uma limitação das ligas, mas sim a consequência de suas microestruturas, caracterizadas pela presença de sítios eletroquimicamente ativos - como partículas intermetálicas e precipitados em contornos de grão - que polarizam a liga anodicamente e comprometem localmente a integridade do filme passivo, favorecendo a iniciação da corrosão por ação de microcélulas galvânicas. No caso específico do ataque intergranular e intragranular observado nas ligas 2024-T3, 2198‑T851 e 7475-T761, estudos prévios indicam que a repassivação tende a ser ineficaz ou até mesmo inexistente, favorecendo a progressão contínua do processo corrosivo, mesmo estando a liga em potencial de circuito aberto,70 como verificado no presente trabalho. Os mapas tridimensionais (Figuras 7 (a4-e4)) permitem a quantificação topográfica da profundidade dos ataques corrosivos. A validação dessas medidas foi feita por determinação da profundidade média do ataque localizado, e por meio da análise das seções transversais correspondentes (Figuras 7 (a5-e5)), cujas imagens possibilitaram aferir com precisão a penetração do ataque. As micrografias em maior ampliação (Figuras 7 (a6-e6)) apresentam detalhes morfológicos das regiões destacadas em A-E nas Figuras 7 (a5-e5). A análise da profundidade média do ataque por pites, determinada com base em 20 medições individuais para cada material, mostrou que, dentre as ligas avaliadas, a 2024-T3 apresentou o ataque mais severo, com profundidade média de 121 ± 15 μm (Figuras 7 (c5-c6)), caracterizado por corrosão intergranular (CIG). O alumínio comercialmente puro (1050-T0) exibiu cavidades com profundidade média de 30 ± 3 μm (Figuras 7 (b5-b6)), enquanto a liga 2198-T851 apresentou pites com profundidade média de 36 ± 7 μm (Figuras 7 (d5-d6)), concentrados em regiões intragranulares. A amostra de alumínio puro também apresentou cavidades mais profundas, com média de 90 ± 12 μm (Figuras 7 (a5-a6)), sugerindo que, apesar do bom desempenho inicial em meio corrosivo, a ruptura localizada do filme passivo propicia a propagação acentuada dos pites, porém, destaca-se que este material apresentou uma menor densidade de pites. Por fim, a liga 7475-T761 apresentou a menor profundidade média de ataque, de 26 ± 5 μm (Figuras 7 (e5-e6)). As diferentes morfologias e intensidade dos ataques localizados reforçam a influência determinante da composição química e da microestrutura tanto na iniciação quanto na propagação do ataque. O fato de o alumínio puro apresentar pites mais profundos que a liga 1050 foi um resultado inesperado, já que, alumínio com elevada pureza química e ausência de elementos de liga, tende a formar filmes passivos mais resistentes, consequentemente, menos suscetíveis à ruptura. Contudo, a quebra do filme passivo sob alta sobretensão ocorre em pontos discretos, assim, a alta razão entre área catódica (matriz protegida pelo filme onde este não foi danificado) e anódica (são poucos os pites formados neste material) favorece a propagação dos pites nucleados, explicando este comportamento. Embora as ligas 2024-T3 e 2198-T851 tenham apresentado valores de potencial de corrosão mais nobres, a propagação do ataque foi consideravelmente mais acentuada. Esse comportamento corrobora os resultados apresentados nas Figuras 3 e 7, nas quais a morfologia do ataque já indicava a ocorrência de mecanismos como CIG, ataque cristalográfico e dissolução seletiva da matriz adjacente a partículas intermetálicas. A análise topográfica em 3D (Figuras 7 (a4-e4)), combinada aos cortes em seção transversal (Figuras 7 (a5-e6)), evidenciou que o impacto da microestrutura sobre a corrosão não pode ser avaliado apenas pela área superficial afetada, sendo crucial considerar também a profundidade e a conectividade interna das cavidades. Para as ligas 2024-T3 e 2198-T851, foram observadas regiões de ataque subsuperficial, com formação de cavidades profundas não conectadas diretamente à superfície. Esses resultados ressaltam a necessidade de uma interpretação criteriosa das imagens de superfície, recomendando-se sua análise em conjunto com os mapas tridimensionais de profundidade para uma caracterização mais precisa da profundidade do ataque corrosivo.71 Os resultados apresentados neste estudo demonstram que a análise do OCP reflete uma resposta eletroquímica média da superfície exposta, sendo fortemente influenciada pelas características predominantes da matriz metálica. Embora essa medida seja amplamente utilizada como referência inicial em ensaios eletroquímicos subsequentes, como curvas de polarização e espectroscopia de impedância eletroquímica (EIS), sua capacidade de predizer a suscetibilidade à corrosão localizada é limitada, especialmente em materiais com microestruturas complexas e heterogêneas, como as ligas comerciais de alumínio empregadas no presente estudo. Nesse sentido, técnicas eletroquímicas locais com elevado poder de resolução, como o SVET (scanning vibrating electrode technique),72 são particularmente eficazes para mapear a distribuição espacial da corrente e identificar com precisão zonas anódicas e catódicas ativas. No entanto, devido à sua alta complexidade instrumental e ao custo elevado, o uso do SVET ainda é restrito a poucos laboratórios especializados. Por isso, técnicas mais acessíveis, como a medição de OCP, devem continuar sendo amplamente empregadas em estudos de corrosão, desde que seus resultados sejam interpretados com cautela e sempre associados a métodos complementares que permitam avaliar fenômenos localizados particularmente influenciados pela microestrutura.
CONCLUSÕES Os resultados obtidos neste estudo demonstram que, embora o potencial de circuito aberto (OCP) e o potencial de corrosão (Ecorr) forneçam informações termodinâmicas úteis, eles não são suficientes para predizer o comportamento frente à corrosão localizada de ligas de alumínio, especialmente daquelas com microestrutura heterogênea. A aplicação de sobrepotenciais positivos revelou que a estabilidade passiva é altamente dependente da presença de sítios eletroquimicamente ativos, como partículas intermetálicas e zonas de contorno de grão, que favorecem a nucleação e a propagação do ataque. As análises morfológicas, tanto após imersão quanto após polarização anódica, reforçam que o comportamento quanto à corrosão está intimamente ligado à distribuição e natureza das heterogeneidades microestruturais. Mesmo o alumínio de alta pureza, que apresentou passividade mais estável, mostrou suscetibilidade significativa à propagação de pites após a ruptura localizada do filme. Essas evidências reforçam que o OCP deve ser interpretado com cautela, sendo recomendado apenas como ferramenta preliminar na avaliação da resistência à corrosão. Para uma compreensão mais realista e confiável, torna-se essencial o uso combinado de técnicas eletroquímicas e métodos de caracterização microestrutural.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto.
AGRADECIMENTOS Os autores agradecem o apoio financeiro fornecido pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), por meio dos auxílios No. 2019/18388-1 e 2022/06935-0, concedidos para os estudos de doutorado de João Victor de Sousa Araujo.
REFERÊNCIAS 1. McCafferty, E.; Introduction to Corrosion Science; Springer: New York, 2010. [Crossref] 2. Evans, U. R.; An Introduction to Metallic Corrosion; Edward Arnold: London, 1948. 3. Birbilis, N.; Muster, T. H.; Buchheit, R. G.; Corrosion Mechanisms in Theory and Practice, 3rd ed.; Marcus, P., ed.; CRC Press: Boca Raton, 2011, p. 705. [Link] acessado em outubro 2025 4. Cramer Junior, S. D.; Covino, B. S.; Corrosion: Fundamentals, Testing, and Protection; ASM International: Materials Park, 2003. [Crossref] 5. Pedeferri, P.; Corrosion Science and Engineering; Springer International Publishing: Cham, 2018. [Crossref] 6. Bastos, A. C.; Dias, S. A. S.; Diamantino, T. C.; Ferreira, M. G. S.; Corros. Prot. Mater. 2013, 32, 50. [Link] acessado em outubro 2025 7. Hussain, C. M.; Verma, C.; Aslam, J.; Aslam, R.; Zehra, S.; Handbook of Corrosion Engineering; Elsevier: Amsterdam, 2023, p. 187. [Crossref] 8. Agostinho, M. S. L.; Jaimes, R. F. V. V.; Barbosa, L. N. G.; INTERCORR 2010; Fortaleza, Brasil, 2010. [Link] acessado em outubro 2025 9. Ramanathan, L. V.; Corrosão e Seu Controle, 3a ed.; Hemus: São Paulo, 1997. 10. Araujo, J.; Silva, R.; Viveiros, B.; Milagre, M.; Machado, C.; Costa, I.; Quim. Nova 2022, 45, 680. [Crossref] 11. Milagre, M. X.; Donatus, U.; Machado, C. S. C.; Araujo, J. V. S.; Silva, R. M. P.; Viveiros, B. V. G.; Astarita, A.; Costa, I.; Corros. Eng., Sci. Technol. 2019, 54, 402. [Crossref] 12. Araujo, J. V. S.; Bugarin, A. F. S.; Donatus, U.; Machado, C. S. C.; Queiroz, F. M.; Terada, M.; Astarita, A.; Costa, I.; Corros. Eng., Sci. Technol. 2019, 54, 575. [Crossref] 13. Milagre, M. X.; Araujo, J. V. S.; Pereira, M.; Donatus, U.; Machado, C. S. C.; Costa, I.; Proceedings of the European Corrosion Congress, 2018. [Link] acessado em outubro 2025 14. Silva, R.; Milagre, M.; Araujo, J. V.; Ramirez, O.; Machado, C.; Antunes, R.; Costa, I.; Quim. Nova 2023, 46, 307. [Crossref] 15. Panossian, R. A. C. Z.; Santos, C. A. L.; Cardoso, J. L.; Silva, A. L. N.; INTERCORR 2014; Fortaleza, Brasil, 2014. [Link] acessado em outubro 2025 16. Coutinho, C. F. B.; Coutinho, L. F. M.; Mazo, L. H.; Quim. Nova 2009, 32, 228. [Crossref] 17. Silva, M. V. F.; Pereira, M. C.; Codaro, E. N.; Acciari, H. A.; Quim. Nova 2014, 37, 1184. [Crossref] 18. Silva, E. F.; Oliveira, L. F. C.; Quim. Nova 2012, 35, 59. [Crossref] 19. Ramires, I.; Guastaldi, A. C.; Quim. Nova 2002, 25, 10. [Crossref] 20. Moreto, J. A.; Marino, C. E. B.; Bose Filho, W. W.; Rocha, L. A.; Fernandes, J. C. S.; Corros. Sci. 2014, 84, 30. [Crossref] 21. Araujo, J. V. S.; Silva, R. M. P.; Viveiros, B. V. G.; Klumpp, R. E.; Costa, I.; Rev. Mater. 2024, 29, e20230328. [Crossref] 22. Donatus, U.; Bodunrin, M. O.; Olayinka, A.; Milagre, M. X.; Oloyede, O. R.; Aribo, S.; Araujo, J. V. S.; Machado, C. S. C.; Costa, I. In Advanced Aluminium Composites and Alloys; Dobrzanski, L. A., ed.; IntechOpen: London, 2021, ch. 5. [Crossref] 23. ASTM G46-21: Standard Guide for Examination and Evaluation of Pitting Corrosion; ASTM International: West Conshohocken, 2021. [Link] acessado em outubro 2025 24. Nișancioǧlu, K.; Holtan, H.; Mater. Corros. 1979, 30, 105. [Crossref] 25. Pyun, S. I.; Lee, W. J.; Corros. Sci. 2001, 43, 353. [Crossref] 26. Galembeck, F.; Costa, C. A. R.; Burgo, T. A. L.; Bernardes, J. S.; Gouveia, R. F.; Cienc. Cult. 2013, 65, 37. [Crossref] 27. Vukmirovic, M. B.; Dimitrov, N.; Sieradzki, K.; J. Electrochem. Soc. 2002, 149, B428. [Crossref] 28. Araujo, J. V. S.; Silva, R. M. P.; Donatus, U.; Machado, C. S. C.; Costa, I.; Mater. Res. 2020, 23, e20200161. [Crossref] 29. Rao, A. C. U.; Vasu, V.; Govindaraju, M.; Srinadh, K. V. S.; Trans. Nonferrous Met. Soc. China 2016, 26, 1447. [Crossref] 30. Vargel, C.; Jacques, M.; Schmidt, M. P.; Corrosion of Aluminium, 1st ed.; Elsevier: London, 2004. [Crossref] 31. Boag, A.; Taylor, R.; Muster, T.; Corros. Sci. 2010, 52, 90. [Crossref] 32. Boag, A.; Hughes, A. E.; Glenn, A. M.; Muster, T. H.; McCulloch, D.; Corros. Sci. 2011, 53, 17. [Crossref] 33. Glenn, A. M.; Muster, T. H.; Luo, C.; Zhou, X.; Thompson, G. E.; Boag, A.; Hughes, A. E.; Corros. Sci. 2011, 53, 40. [Crossref] 34. Hughes, A. E.; Boag, A.; Glenn, A. M.; McCulloch, D.; Muster, T. H.; Ryan, C.; Luo, C.; Zhou, X.; Thompson, G. E.; Corros. Sci. 2011, 53, 27. [Crossref] 35. Grilli, R.; Baker, M. A.; Castle, J. E.; Dunn, B.; Watts, J. F.; Corros. Sci. 2010, 52, 2855. [Crossref] 36. Araujo, J. V. S.; Costa, I.; Zhou, X.; Metallogr., Microstruct., Anal. 2025, 14, 106. [Crossref] 37. Araujo, J.; Silva, R.; Milagre, M.; Machado, C.; Costa, I.; Quim. Nova 2020, 43, 1058. [Crossref] 38. Birbilis, N.; Buchheit, R. G.; J. Electrochem. Soc. 2008, 155, C117. [Crossref] 39. Buchheit, R. G.; J. Electrochem. Soc. 1995, 142, 3994. [Crossref] 40. Latimer, W. M.; The Oxidation States of the Elements and Their Potentials in Aqueous Solutions, 1st ed.; Prentice-Hall: New York, 1932. 41. Queiroz, F. M.; Magnani, M.; Costa, I.; Melo, H. G.; Corros. Sci. 2008, 50, 2646. [Crossref] 42. Araujo, J. V. S.; Milagre, M. X.; Ferreira, R. O.; Machado, C. S. C.; Abreu, C. P.; Costa, I.; Metallogr., Microstruct., Anal. 2020, 9, 744. [Crossref] 43. Frankel, G.; Corrosion 2015, 71, 1308. [Crossref] 44. Shibata, T.; Corrosion 1996, 52, 813. [Crossref] 45. Zhang, W.; Frankel, G.; J. Electrochem. Soc. 2002, 149, B134. [Crossref] 46. Zhang, X.; Zhou, X.; Hashimoto, T.; Liu, B.; Mater. Charact. 2017, 130, 230. [Crossref] 47. Milagre, M. X.; Machado, C. S. C.; Araujo, J. V.; Astarita, A.; Pébère, N.; Vivier, V.; Costa, I.; The Annual Congress of the European Federation of Corrosion (EUROCORR 2017) and 20th International Corrosion Congress and Process Safety Congress; Prague, Czech Republic, 2017. [Link] acessado em outubro 2025 48. Codaro, E. N.: Estudo da Corrosão em Ligas de Alumínio Utilizadas na Indústria Aeronáutica; Tese de Doutorado, Faculdade de Engenharia de Guaratinguetá, Guaratinguetá, Brasil, 2006. [Link] acessado em outubro 2025 49. Brennan, S. J.; Breslin, C. B.; Quinn, C. M.; J. Electrochem. Soc. 1997, 144, L217. [Crossref] 50. Ma, Y.; Zhou, X.; Huang, W.; Thompson, G. E.; Zhang, X.; Luo, C.; Sun, Z.; Mater. Chem. Phys. 2015, 161, 201. [Crossref] 51. Buchheit, R. G.; Grant, R. P.; Hiava, P. F.; McKenzie, B.; Zender, G.; J. Electrochem. Soc. 1997, 144, 2621. [Crossref] 52. Birbilis, N.; Buchheit, R. G.; J. Electrochem. Soc. 2005, 152, B140. [Crossref] 53. Cavanaugh, M. K.; Li, J. C.; Birbilis, N.; Buchheit, R. G.; J. Electrochem. Soc. 2014, 161, C535. [Crossref] 54. Hughes, A. E.; Glenn, A. M.; Wilson, N.; Moffatt, A.; Morton, A. J.; Buchheit, R. G.; Surf. Interface Anal. 2013, 45, 1558. [Crossref] 55. Wranglen, G.; An Introduction to Corrosion and Protection of Metals; Springer: Dordrecht, 1985. 56. Liao, C. M.; Wei, R. P.; Electrochim. Acta 1999, 45, 881. [Crossref] 57. Andreatta, F.; Terryn, H.; De Wit, J. H. W.; Electrochim. Acta 2004, 49, 2851. [Crossref] 58. Andreatta, F.; Terryn, H.; De Wit, J. H. W.; Corros. Sci. 2003, 45, 1733. [Crossref] 59. Andreatta, F.; Lohrengel, M. M.; Terryn, H.; De Wit, J. H. W.; Electrochim. Acta 2003, 48, 3239. [Crossref] 60. Kayani, S. H.; Ha, H. Y.; Kim, B. J.; Cho, Y. H.; Son, H. W.; Lee, J. M.; Corros. Sci. 2024, 233, 112064. [Crossref] 61. Akuata, C. K.; Belkacemi, L. T.; Zander, D.; Mater. Charact. 2024, 215, 114186. [Crossref] 62. Chen, G. S.; Gao, M.; Wei, R. P.; Corrosion 1996, 52, 8. [Crossref] 63. Schneider, O.; Ilevbare, G. O.; Scully, J. R.; Kelly, R. G.; J. Electrochem. Soc. 2004, 151, B465. [Crossref] 64. Seo, J. H.; Ryu, J. H.; Lee, D. N.; J. Electrochem. Soc. 2003, 150, B433. [Crossref] 65. Zhou, B.; Liu, B.; Zhang, S.; Metals 2021, 11, 718. [Crossref] 66. Svenningsen, G.; Larsen, M. H.; Nordlien, J. H.; Nisancioglu, K.; Corros. Sci. 2006, 48, 3969. [Crossref] 67. Moreto, J. A.; dos Santos, M. S.; Ferreira, M. O. A.; Carvalho, G. S.; Gelamo, R. V.; Aoki, I. V.; Taryba, M.; Bose Filho, W. W.; Fernandes, J. C. S.; Corros. Sci. 2021, 182, 109253. [Crossref] 68. Lv, Y.; Hashimoto, T.; Zhou, X.; Zhang, X.; Corrosion Communications 2024, 15, 13. [Crossref] 69. Meng, Q.; Frankel, G. S.; J. Electrochem. Soc. 2004, 151, B271. [Crossref] 70. Huang, T. S.; Frankel, G. S.; Corros. Sci. 2007, 49, 858. [Crossref] 71. Araujo, J. V. S.; Gabbardo, A. D.; Fernandes, S. M.; Costa, I.; Quim. Nova 2025, 48, e-20250067. [Crossref] 72. Bastos, A. C.; Quevedo, M. C.; Ferreira, M. G. S.; Corros. Sci. 2015, 92, 309. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access